La drépanocytose : molécules biologiques & état de santé
Jean-Pierre et Danielle Chouzenoux (Lycée Jay de Beaufort-Périgueux-24)
- Répartition géographique de la maladie
- Formule sanguine d’un sujet normal et d’un sujet atteint de drépanocytose
- La circulation sanguine
- Les propriétés de l’hémoglobine
- Composition en acides aminés des globines
- Structure tridimensionnelle des globines
- Approfondir ce sujet …
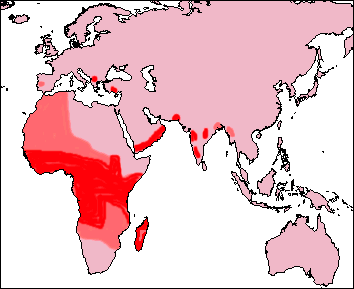
Répartition géographique :
Cette « maladie » est relativement fréquente en Afrique (zones rouges).
Elle n’est pas contagieuse. Les personnes atteintes ont un taux de mortalité supérieur à la moyenne. La mortalité juvénile est très importante, avant 20 ans (87% est un chiffre donné pour les Etats-Unis).
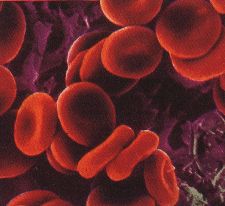
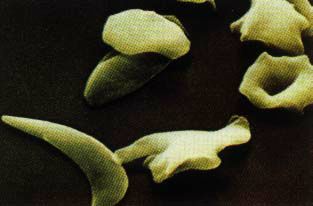
Cellules sanguines et numération globulaire :
Voici deux images représentant les globules rouges (hématies) en couleurs artificielles :
|
Globules rouges d’un sujet |
Globules rouges d’un sujet |
Numération globulaire :
Evaluez le nombre de globules rouges par ml de sang
|
Sang normal : effectuez un comptage sous microscope à partir d’un frottis sanguin. Vous donnerez les résultats en nombre de globules rouges (hématies) par mm3. |

Drépanocytose : Considérant que la photo ci dessus représente 2.10-4 mm3 de sang. |
La circulation dans les capillaires :
Mesures par effet DOPPLER
L’effet DOPPLER permet d’estimer la vitesse de déplacement des globules rouges dans les vaisseaux : après traitement numérique, les couleurs (artificielles) sont d’autant plus chaudes que la vitesse est mportante.

Sujet sain |

Sujet malade |
Les clichés montrent la circulation au niveau d’une bifurcation (sens de circulation : de droite à gauche).
Les propriétés de l’hémoglobine :
 |
Le graphe ci-contre représente les effectifs de globules rouges (en % du total) en fonction de leur densité (elle-même liée à l’hémoglobine qu’ils renferment) chez deux sujets, un sain, un malade. |
Observation de globules rouges au microscope électronique à transmission

Hémoglobine normale |

Hémoglobine de malade |
L’hémoglobine des malades (HbS) est susceptible de précipiter dans le cytoplasme des hématies, surtout à basse pression d’oxygène, donc au niveau des vaisseaux capillaires des tissus (là où l’hémoglobine se décharge de son dioxygène et se charge en dioxyde de carbone). Ces précipités d’HbS rigidifient les globules rouges. Ainsi déformés, ils prennent l’aspect de faucilles, d’où le nom d’anémie falciforme.
La solubilité de l’HbS correspond à 4% de la solubilité de l’HbA.
Des douleurs apparaissent, notamment au niveau des articulations. Certains organes, mal irrigués, sont susceptibles d’être endommagés. Les hématies déformées ont une durée de vie courte et sont détruites très rapidement au niveau du foie.
Composition des Globines constituant l’hémoglobine :
Après identification des anomalies sanguines, on peut rechercher l’anomalie dans les composants internes des globules rouges.
L’hémoglobine (pigment rouge transportant l’oxygène) est constitué de différents éléments, dont des globines (protéines).
Chaîne protéique d’une globine ß normale : BETA.PRO
MVHLTPEEKSAVTALWGKVNVDEVGGEALGRLLVVYPWTQRFFESFGDLSTPDAVMGNPKVKAH
GKKVLGAFSDGLAHLDNLKGTFATLSELHCDKLHVDPENFRLLGNVLVCVLAHHFGKEFTPPVQA
AYQKVVAGVANALAHKYH
Chaîne protéique de la globine d’un sujet atteint de drépanocytose : DREP.PRO
>MVHLTPVEKSAVTALWGKVNVDEVGGEALGRLLVVYPWTQRFFESFGDLSTPDAVMGNPKVKAH
GKKVLGAFSDGLAHLDNLKGTFATLSELHCDKLHVDPENFRLLGNVLVCVLAHHFGKEFTPPVQA
AYQKVVAGVANALAHKYH
tableau de correspondance pour la désignation des acides aminés (code international) :
| A : Alanine | Ala | M : Méthionine | Met | C : Cystéine | Cys | N : Asparagine | Asn | D : Aspartate | Asp |
| P : Proline | Pro | E : Glutamate | Glu | Q : Glutamine | Gln | F : Phénylalanine | Phe | R : Arginine | Arg |
| G : Glycine | Gly | S : Sérine | Ser | H : Histidine | His | T : Thréonine | Thr | I : Isoleucine | Ile |
| V : Valine | Val | K : Lysine | Lys | W : Tryptophane | Trp | L : Leucine | Leu | Y : Tyrosine | Tyr |
Représentation des molécules dans l’espace :
Visualiser les molécules de globine en 3 dimensions avec le logiciel RASMOL :
Molécule normale : BETANORM.PDB
Molécule anormale : BETADREP.PDB
ATTENTION :
le fichier PDB de chaque molécule a été privé du premier a.a. (méthionine)
l’anomalie indiquée ci-dessus concerne donc désormais l’acide aminé n° 6…
Mode d’emploi succint :
Seule la version 2.6-ucb de Rasmol permet d’afficher plusieurs molécules dans la même fenêtre.
1°) Comment visualiser des molécules ?
Lancer le logiciel RASMOL 2.6, deux fenêtres apparaissent…
Faire apparaître la troisième fenêtre (Fenêtre de commande : cliquer dans la barre inférieure de l’écran Windows 95 ou 98 : « Rasmol Command Line »)
Positionner les 3 fenêtres de façon harmonieuse sur l’écran :
- fenêtre de Visualisation aussi grande que possible (laissant entrevoir les deux autres fenêtres)
- fenêtre de Commande en bas,
- fenêtre « Rasmol Molécules » en haut à droite…
Afficher alors les molécules dans la fenêtre de visualisation :
- Charger la première molécule (File… Load)…
- Désactiver « Hetero Atoms » et « Hydrogens » dans le menu « Options »…
- Choisir une visualisation (Display) « Backbone » (dans le menu « Display »)…
- Repositionner la molécule à gauche de l’écran en la déplaçant avec la souris (appuyer sur le bouton droit de la souris).
- Charger la seconde molécule…
- Désactiver « Hetero Atoms » et « Hydrogens » dans le menu « Options »…
- Choisir une visualisation (Display) « Backbone » (dans le menu « Display »)…
- Repositionner la molécule à droite de l’écran en la déplaçant avec la souris (bouton droit ).
Pour sélectionner une molécule, cliquer dessus, ou la sélectionner en cliquant sur son nom dans la fenêtre « Molécules »
Rechercher des différences de forme en faisant tourner les molécules et en les plaçant toutes deux exactement dans la même position…
2°) Mettre en évidence des différences :
A partir de vos observations précédentes (position des acides aminés, numéro de l’a.a. muté), utiliser les fonctions de Rasmol pour repérer la fraction normale (dans BETANORM) puis la fraction modifiée (dans BETADREP) :
pour chaque molécule, activer la fenêtre de commande qui est soit en arrière plan, soit dans la barre de menu (Windows 95 ou 98), puis :
- sélectionner l’acide aminé 6 : écrire select 6 puis valider (ne pas oublier l’espace entre select et 6),
- mise en couleur (vert par ex.) : écrire color Green et valider,
- visualisation de la partie sélectionnée en « Spacefill » (cliquer sur l’article correspondant dans le menu déroulant « Display »)…
N.B. : les commandes saisies au clavier (couleur, mode d’affichage) s’appliquent uniquement à la sélection (ici l’a.a. n° 6)
Visualiser de la même façon les parties voisines de la zone concernée :
- select 1-5 (début de la chaîne)
- color red… (rouge par ex)
- visualisation « spacefill »… etc…
N.B. : les commandes saisies au clavier s’appliquent uniquement aux molécules sélectionnées (ici les a.a. n° 1 à n° 5)
Chercher une différence d’aspect significative des zones mises en valeur en faisant tourner les molécules, en sélectionnant d’autres acides aminés si nécessaire…
Et pour aller plus loin dans la compréhension des mécanismes modifiant les propriétés de l’hémoglobine
1°) Comment les molécules d’HbS se fixent-elles les unes aux autres, déformant ainsi les globules rouges ?
Chargez l’ensemble HbSHbS.pdb (deux molécules d’HbS associées).
Recherchez les acides aminés par lesquels elle semblent reliées :
- cliquer sur la molécule en mode d’affichage « Backbone »
- rechercher d’abord l’a. a. muté (Valine n° 6) : sélectionner, colorier, afficher en mode « Spacefill »…
- chercher ensuite l’acide aminé de l’autre molécule auquel la Valine semble reliée… En cliquant, Raswin affiche le nom et le n° de l’acide aminé dans la fenêtre de commande…
Après avoir identifié l’acide aminé associé à la valine, chargez les deux dans l’espace de travail. Les acides aminés isolés sont rangés dans un dossier AA (acides aminés).
Placez les dans la même position que dans le complexe HbS-HbS…
Quelles sont les structures en contact ?
2°) Les propriétés des acides aminés sont-elles différentes ?
Cela a-t-il des effets sur les caractéristiques de l’hémoglobine ?
Leucine (Leu.pdb) et Valine (Val.pdb) ont des chaînes latérales (à déterminer) non polaires ethydrophobes.
L’acide glutamique (Glu.pdb) a une chaîne latérale (à déterminer) très polaire chargée négativement ettrès hydrophile.
Sous réserve de Vérification :
Déposer avec la pointe d’un scalpel quelques cristaux de Leucine ou de Valine dans un verre de montre contenant 1 ml d’eau distillée.
Faire de même avec de l’Acide Glutamique…
Mélanger chaque préparation avec un agitateur et évaluer la vitesse de dissolution de chaque molécule…
Expérimentation :
a) Vous allez séparer des acides aminés en mélange en réalisant une électrophorèse (migration dans un champ électrique).
- Le mélange contient deux acides aminés que vous devrez identifier.
- Vous disposez de deux acides aminés témoins (Valine, Acide Glutamique)
- Utilisez la fiche technique « Electrophorèse »…
- Observez les résultats et tirez en une conclusion…
- Comparez la molécule de Valine (présente dans HbS) à la molécule díAcide glutamique (Hb normale) avec Raswin.
- Proposez une explication aux différences observées lors de l’électrophorèse.
b) Un seul acide aminé différent peut-il modifier les propriétés díune protéine ?
Observation díélectrophorèses de protéines HbA (normale) et HbS (drépanocytose).
–  + + |
Hb A (normale) |
–  + + |
HbS (drépanocytose) |
Conclusion générale…